酵母や麹菌は、私たちの日常の食生活に密接に関わっている微生物です。例えば、パンがふっくら焼き上がるには酵母が必要ですし、ビール・ワイン・日本酒・焼酎などは、酵母の発酵能力によってできあがります。麹菌は、焼酎や日本酒を造るときサツマイモや米などに含まれるデンプンを分解してブドウ糖をつくります。酵母はこのブドウ糖から二酸化炭素とアルコールをつくるのです。そのほかにも酵母や麹菌は、酢、味噌、醤油などの醸造食品に広く用いられています。私たちは、これら酵母や麹菌が、醸造における様々な環境に適応するメカニズムの解明を行うことでより良い発酵食品を作ることのできる醸造微生物の育種をめざして研究を行っています。
また、酵母は、ヒトと同じ真核生物であり、優れたモデル生物として非常に多くの研究に用いられています。生命現象の中で重要な機構は、ヒトから酵母にいたるまで広く保存されていることから、私たちは、酵母の研究を通して全ての生物に共通した生命現象のメカニズムを明らかにする研究にも取り組んでいます。
研究テーマ
①焼酎酵母分子育種のための基盤形成
酵母の育種においては、特定の遺伝子を働かなくすることで、これまでにない代謝生成物の蓄積により新たな味や香りの製品を生み出すことができ、その組み合わせは無限に存在すると考えられています。
これまでの酵母の育種法は、紫外線照射や変異剤処理により遺伝子に損傷を引き起こすことで行われてきました。しかしこの方法では、目的の遺伝子のみをターゲットとすることはできず、また目的以外の遺伝子にも損傷を与えてしまう恐れを含んでいるのです。さらに、醸造用酵母は2倍体であるために同じ遺伝子を2つ持つことから、それら2つの遺伝子を1度に働かなくすることは確率的に非常に低く、そのため変異株の取得には多大な時間と労力を要するものなのです。私たちは、ヘテロ接合性消失(LOH; Loss of Heterozygosity)という現象を利用した簡便な焼酎酵母の遺伝子破壊方法の構築を目的として研究を行っています。
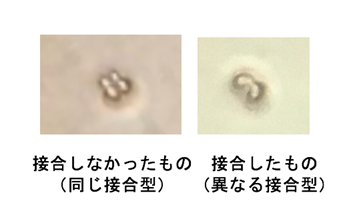
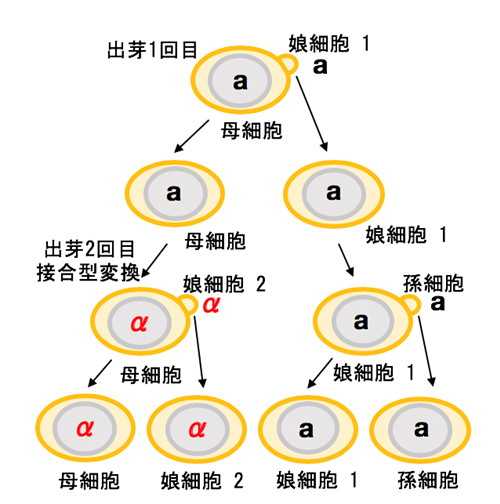
また、交配による優良株の育種法の開発にも取り組んでいます。醸造用酵母は通常2倍体ですが、減数分裂後に生じた胞子が発芽した1倍体細胞は異なる接合型の株同士で接合して2倍体となります。このため異なる株同士の接合による育種が試みられてきました。しかしながら清酒酵母は胞子形成能ならびに胞子発芽能が極めて低いことから、これまで交配による育種法は確立されていません。私たちは、焼酎酵母が清酒酵母と近縁であるにもかかわらず高い胞子形成能ならびに胞子発芽能を有することを見出しました。また、ホモタリック注1)な焼酎酵母においても、マイクロマニピュレーターを用いて単離した胞子を隣接させることで確実に交配株が得られる顕微接合法を開発し(図1A)、交配による育種法についても研究しています。
注1)出芽酵母の1倍体細胞は2つの接合型(aとα)のいずれかを示す。ホモタリック株は、増殖に際し一部の細胞で接合型が変換するが(図1B)ヘテロタリック株では接合型変換は起こらない。
②酵母の細胞膜リン脂質リモデリングの解明
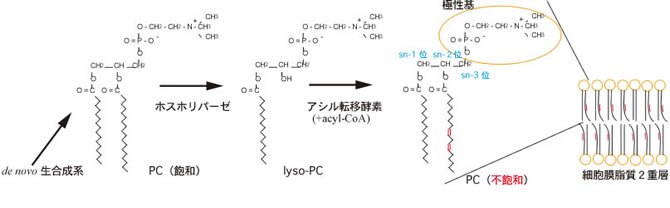
細胞膜は半透性の脂質2重層からできていてこれによって細胞質と外環境を隔てています。細胞膜の主な構成成分であるリン脂質は、酸化などによって不飽和結合が切断された場合などに短くなったアシル鎖を切り離しリゾリン脂質とした後、新たなアシル鎖を導入するメンテナンス機構が存在し、これを脂質のリモデリングといいます(図2)。前者を触媒するのがホスホリパーゼなどのエステル分解酵素であり、後者を触媒するのがアシル転移酵素と考えられています。しかしながら、これらの酵素とリモデリングの関連はほとんど解明されておらず、特にリゾリン脂質を受容体基質とするアシル転移酵素に関しては全く同定されていませんでした。
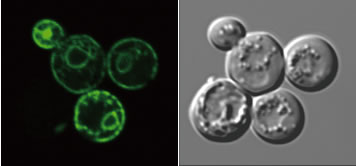
私たちは、出芽酵母全遺伝子のうち致死でない約5,000の遺伝子を1つずつ破壊した遺伝子破壊株のセットについてスクリーニングを行い、1株だけ活性を持たない株を見出しLPT1と命名しました。LPT1は、membrane bound O-acyltransferase (MBOAT) スーパーファミリーのモチーフを持ち、酵母からヒトにいたるまでホモログが見出されましたがこれまでに研究されていない新規な酵素であることが分かりました。私たちは、Lpt1-GFPが小胞体膜上に局在すること(図3)、Lpt1がさまざまなリン脂質に基質特異性を示すこと、リゾフォスファチジン酸 (LPA)の生合成をもう一つのアシル転移酵素Slc1と協調して行うことを明らかにするとともにさらなる研究を続けています。
LPT1 encodes a membrane-bound O-acyltransferase involved in the acylation of lysophospholipids in the yeast Saccharomyces cerevisiae. Tamaki, H., Shimada, A., Ito, Y., Ohya, M., Takase, J., Miyashita, M., Miyagawa, H., Nozaki, H., Nakayama, R., and Kumagai, H. (2007) J. Biol. Chem., 282, 34288-34298.
③麹菌のクエン酸生成機構の解明
焼酎醸造においては白麹菌や黒麹菌が生産するクエン酸によりもろみが酸性となることにより雑菌の生育を抑えます。麹製造の前半は発酵熱により比較的高温で推移しますが、クエン酸は高温ではあまり生産されないため、麹製造の後期では温度を35℃程度に低下させる必要があります。しかしながら、温度を下げるとなぜクエン酸が生産されるのか、そもそもどのような機構でクエン酸を高生産できのかについては分かっていませんでした。
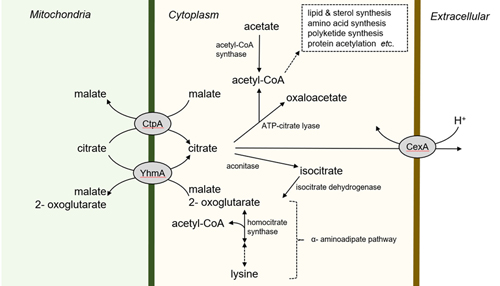
クエン酸は、ミトコンドリアのTCA(Tricarboxylic Acid)回路の中間代謝物として合成されたものが、細胞質、続いて細胞外へと排出されます。私たちは、クエン酸がミトコンドリアから、細胞質、そして細胞外へと排出されるために必要なクエン酸輸送体について解析し、ミトコンドリア膜ではCtpAとYhmAが主要なクエン酸輸送体であることを明らかにしました(図4)。また、CtpAとYhmAによって細胞質に排出されたクエン酸の一部は、アセチルCoA合成に使われていることを明らかにしました。また、細胞質膜に局在するクエン酸輸送体CexAがクエン酸高生産にきわめて重要であり、その遺伝子発現がエピジェネティックに制御されることを明らかにし、さらなる研究を続けています。これらのクエン酸輸送体に関する知見は、有用物質生産における輸送体をターゲットとした育種戦略への活用が期待されます。
- 二神泰基, 門岡千尋. 焼酎造りに用いられる白麹菌のクエン酸高生産機構. バイオサイエンスとインダストリー. 78, 213-216, 2020.
- Kadooka C, Nakamura E, Mori K, Okutsu K, Yoshizaki Y, Takamine K, Goto M, Tamaki H, Futagami T. (2020) LaeA controls citric acid production through regulation of the citrate exporter-encoding cexA gene in Aspergillus luchuensis mut. kawachii. Appl Environ Microbiol. 86, e01950-19.
- Miyamoto A, Kadooka C, Mori K, Tagawa Y, Okutsu K, Yoshizaki Y, Takamine K, Goto M, Tamaki H, Futagami T. (2020) Sirtuin SirD is involved in α-amylase activity and citric acid production in Aspergillus luchuensis mut. kawachii during a solid-state fermentation process. J Biosci Bioeng. 129, 454-466.
- Kadooka C, Izumitsu K, Onoue M, Okutsu K, Yoshizaki Y, Takamine K, Goto M, Tamaki H, Futagami T. (2019) Mitochondrial citrate transporters CtpA and YhmA are required for extracellular citric acid accumulation and contribute to cytosolic acetyl-CoA generation in Aspergillus luchuensis mut. kawachii. Appl. Environ. Microbiol. 85, AEM.03136-18.
- Futagami T, Mori K, Wada S, Ida H, Kajiwara Y, Takashita H, Tashiro K, Yamada O, Omori T, Kuhara S, Goto M. (2015) Transcriptomic analysis of temperature responses of Aspergillus kawachii during barley koji production. Appl. Environ. Microbiol. 81, 1353-1363.
④焼酎麹菌の分子育種のための基盤構築
近年、高速シーケンス技術や質量分析の技術が進展したことによって、ゲノム情報、網羅的な遺伝子や蛋白質の発現情報を比較的容易に取得できる時代となりました。私たちも、麹菌(図5)がクエン酸や酵素を効率よく高分泌生産するメカニズムを解析するためにこれらの技術を利用しています。しかし、このような膨大な情報を最終的に活用するためには、麹菌のゲノムの目的の部位に効率よく遺伝子を挿入したり、ゲノム編集する技術が必要で、私たちはその開発に取り組んでいます。
白麹菌を含む糸状菌のおおくは、DNA修復時に非相同末端結合(Non-Homologous End Joining, NHEJ)が相同組換えよりも活発にはたらくために目的の部位で遺伝子組換えすることが困難で、NHEJに関わる遺伝子をあらかじめ破壊することで相同組換えを効率化することが行われています。私たちは、白麹菌において非相同末端結合に必要なku70遺伝子を破壊することにより相同組換え効率が劇的に上昇した宿主を構築し、研究に用いています。また、ATP sulfurylase をコードするsC遺伝子を欠損するとセレン酸耐性となり、獲得するとメチオニン非要求性となるという性質を利用してsC遺伝子を繰り返しマーカーとして利用できる実験系を使用しています。さらに、ゲノム編集技術であるCRISPR-Cas9システムを用いて、非相同末端結合が正常にはたらいている白麹菌の野生株においても高効率で遺伝子をノックアウトする技術を開発しました。現在も、麹菌を研究し、分子育種するための基盤整備を続けています。

- Kimoto D, Kadooka C, Saenrungrot P, Okutsu K, Yoshizaki Y, Takamine K, Goto M, Tamaki H, Futagami T. (2019) Pex16 is involved in peroxisome and Woronin body formation in the white koji fungus, Aspergillus luchuensis mut. kawachii. J. Biosci. Bioeng. 127, 85-92.
- Kojo T, Kadooka C, Komohara M, Onitsuka S, Tanimura M, Muroi Y, Kurazono S, Shiraishi Y, Oda K, Iwashita K, Onoue M, Okutsu K, Yoshizaki Y, Takamine K, Futagami T, Mori K, Tamaki H. (2018) Characterization of amylolytic enzyme overproducing mutant of Aspergillus luchuensis obtained by ion beam mutagenesis. J. Gen. Appl. Microbiol. 63, 339-346.
- Kadooka C, Onitsuka S, Uzawa M, Tashiro S, Kajiwara Y, Takashita H, Okutsu K, Yoshizaki Y, Takamine K, Goto M, Tamaki H, Futagami T. (2016) Marker recycling system using the sC gene in the white koji mold, Aspergillus luchuensis mut. kawachii. J. Gen. Appl. Microbiol. 62, 160-163.
- 二神泰基, 後藤正利. 焼酎製造に用いられる白麹菌のゲノム解析と育種基盤の開発. バイオサイエンスとインダストリー. 74, 402-205, 2016.
- Futagami T, Mori K, Yamashita A, Wada S, Kajiwara Y, Takashita H, Omori T, Takegawa K, Tashiro K, Kuhara S, Goto M. (2011) Genome sequence of the white Koji mold Aspergillus kawachii IFO 4308 used for brewing the Japanese distilled spirit Shochu. Eukaryot. Cell. 10, 1586-1587.
⑤酵母の栄養源認識とシグナル伝達機構の解明
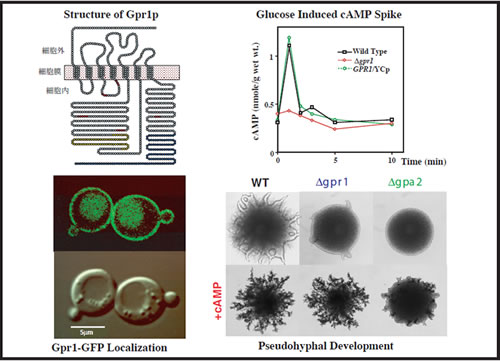
酵母は自らを取り巻く環境中の栄養状況をモニターして増殖や分化への切換えを行っています。たとえば代表的な栄養源であるグルコースは、細胞内のcAMPレベルを上昇させることで増殖のスイッチをONにすると考えられています。ところが、グルコースを感知する受容体に関しては、これまで全くわかっていませんでした。私たちは、グルコースシグナル伝達経路に関与すると考えられていた3量体Gタンパク質に着目し、その分子と共役する遺伝子GPR1をクローニングすることに成功しました。GPR1は7回膜貫通型の典型的なGタンパク質共役型受容体(図6,左上)をコードしており、クラゲの緑色蛍光タンパク質(GFP)と融合させて共焦点レーザー顕微鏡で観察すると、細胞表層の細胞膜に局在することがわかりました(図6,左下)。GPR1遺伝子を破壊した株では、グルコース添加による細胞内cAMPレベルの一過的な上昇が見られなくなったことから(図6,右上)Gpr1タンパク質は、グルコース受容体であることが明らかとなりました。出芽酵母は栄養状況に応じて形態を変化させます。たとえば2倍体細胞を高グルコース・低窒素源条件下におくと、偽菌糸形成 (Pseudohyphal growth) とよばれる一見カビの様な菌糸状の増殖形態をとります(図6,右下)。私たちは、GPR1遺伝子破壊株およびGタンパク質であるGPA2遺伝子破壊株では、偽菌糸形成が起こりにくくなり、また培地中へのcAMPの添加が偽菌糸形成不全を回復させる(抑圧する)ことからcAMP経路は細胞の増殖のみならず分化をも制御していることを明らかにしました。
- Loss of heterozygosity is induced in Candida albicans by ultraviolet irradiation. Takagi, Y., Akada, R., Kumagai, H., Yamamoto, K., and Tamaki, H. (2008) Appl. Microbiol. Biotechnol., 77, 1073-1082
- Glucose-Stimulated cAMP-PKA Pathway in Yeast Saccharomyces cerevisiae. Tamaki, H. (2007) J. Biotech. Bioeng., 104(4), 245-250.
- Glucose-dependent cell size is regulated by a G protein-coupled receptor system in yeast Saccharomyces cerevisiae. H. Tamaki, C.-W. Yun, T. Mizutani, T. Tsuzuki, Y. Takagi, M. Shinozaki, Y. Kodama, K. Shirahige, and H. Kumagai. (2005) Genes Cells, 10 (3), 193-206.
- Gpr1, a Putative G-Protein-Coupled Receptor, Regulates Morphogenesis and Hypha Formation in the Pathogenic Fungus Candida albicans. T. Miwa, Y. Takagi, M. Shinozaki, C.-W. Yun, W. A. Schell, J. R. Perfect, H. Kumagai, and H. Tamaki.(2004)
- Eukaryot. Cell, 3 (4), 919-931.
- Characterization of heterotrimeric G protein complexes in rice plasma membrane.Kato, T., Mizutani, T., Tamaki, H., Kumagai, H., Kamiya, T., Hirobe, A., Fujisawa, Y., Kato, H., and Iwasaki, Y. (2004) Plant J., 38 (2), 320-331.
- GPR1 regulates filamentous growth through FLO11 in yeast Saccharomyces cerevisiae. Tamaki, H., Miwa, T., Shinozaki, M., Saito M., Yun, C.-W., Yamamoto, K., and Kumagai, H. (2000) Biochem. Biophys. Res. Commun., 267, 164-168.
- Gpr1p, a putative G-protein coupled receptor, regulates glucose dependent cellular cAMP level in yeast Saccharomyces cerevisiae. Yun, C.-W., Tamaki, H., Nakayama, R., Yamamoto, K. and Kumagai, H. (1998) Biochem. Biophys. Res. Commun., 252, 29-33
- G-Protein Coupled Receptor from Yeast Saccharomyces cerevisiae. Yun, C.-W., Tamaki, H., Nakayama, R., Yamamoto, K., and Kumagai, H. (1997) Biochem. Biophys. Res. Commun., 240, 287-292